Цель исследования. Изучение состояния почечной паренхимы и внутрипочечной гемодинамики у детей и подростков, больных сахарным диабетом, методом эхо- и допплерографии и разработка ультразвуковых критериев поражения почек на разных стадиях диабетической нефропатии.
Материал и методы. Обследованы 60 детей и подростков, больных инсулинзависимым сахарным диабетом, с различной длительностью основного заболевания. Из них 29 (48,3%) мальчиков и 31 (51,7%) девочка, возраст обследованных составил от 6 до 18 лет. Во время исследования оценивали состояние почечной паренхимы, чашечно-лоханочной системы и количественные характеристики внутрипочечного кровотока на разных уровнях сосудистого русла.
Результаты. У 15 (24%) человек выявлены синдром склеротических изменений и синдром "эхоплотного перимедуллярного кольца". Уродинамические нарушения в виде пиелоэктазии и гипотонии лоханок обнаружены у 27 (45%) человек. При исследовании кровотока у пациентов с начальными гемодинамически значимыми признаками нефропатии (фаза гиперфильтрации и гиперперфузии почек) зафиксировано достоверное повышение показателей гемодинамики (PI, RI, S/D) на магистральной почечной артерии и снижение их к периферии, особенно отчетливо проявляющееся на уровне дуговых и междольковых артерий. Выявлена достоверная корреляция эхо- и допплерографических критериев поражения почек с другими клинико-лабораторными данными, характеризующими стадии диабетической нефропатии (микроальбуминурия, артериальная гипертензия).
Заключение. Достоверная корреляция данных ультразвукового исследования с клинико-лаборатоными критериями поражения почек у детей и подростков позволяет рекомендовать данный метод обследования для подтверждения диагноза и уточнения стадии диабетической нефропатии.
Ключевые слова: сахарный диабет, дети и подростки, почки, ультразвуковое иследование, внутрипочечный кровоток.
Диабетическое поражение почек (диабетическая нефропатия) — одно из наиболее грозных сосудистых осложнений сахарного диабета (СД), влекущее за собой раннюю инвалидизацию больных и их гибель от терминальной почечной недостаточности (1). Несмотря на это, диабетическая нефропатия (ДН) — прогнозируемое осложнение, развивающееся, в первую очередь, при неудовлетворительной компенсации и предотвратимое в случае своевременной диагностики и лечения.
Эндокринологами и нефрологами постоянно ведется поиск оптимальных диагностических критериев начальных проявлений ДН. В последнее время разработаны и широко внедрены в практику высокоинформативные методы диагностики этого осложнения на доклинической стадии: исследование скорости клубочковой фильтрации (СКФ), функционального почечного резерва, суточной микроальбуминурии (МАУ) (1-4).
С нашей точки зрения, также представляет интерес эхографическая оценка состояния почек и почечной гемодинамики у больных сахарным диабетом 1 типа, особенно в группе детей и подростков, поскольку основная масса публикаций по этой проблеме посвящена изучению ДН у взрослой популяции больных СД (5-8).
Целью исследования явилось изучение состояния почечной паренхимы, чашечно-лоханочной системы и внутрипочечной гемодинамики у детей и подростков, больных сахарным диабетом, методом эхо- и допплерографии в зависимости от стажа заболевания, степени компенсации углеводного обмена, показателей, отражающих функциональное состояние почек, а также разработка допплерометрических критериев поражения почечных сосудов на ранней стадии диабетической нефропатии.
Обследованы 60 пациентов, больных сахарным диабетом 1 типа, в возрасте от 6 до 17 лет, из них 29 (48,3%) мальчиков и 31 (51,7%) девочка. Контрольную группу составили 12 здоровых детей и подростков. Всем проведено ультразвуковое исследование в B-, D-, ЦДК-режимах и режиме энергетического допплера (ЭД) на ультразвуковых сканерах "Image Point" (Hewlett Packard, США), "ProSound SSD-5000" (Aloka, Япония). Использовался конвексный датчик с частотой сканирования 3,5 — 5 МГц.
При исследовании в В-режиме оценивались четкость контура почек, состояние почечной паренхимы и чашечно-лоханочной системы.
Дуплексное допплеровское сканирование и импульсноволновая допплерометрия почечных сосудов проводились на уровне магистральной почечной артерии (МПА), сегментарных (СА), междолевых (МА), дуговых (ДА) и междольковых (МДА) артерий. Для количественной характеристики почечного кровотока использовались "почти уголнезависимые" показатели периферического сосудистого сопротивления (резистивности): S/D — систоло-диастолическое соотношение, PI — пульсационный индекс, RI — индекс резистентности. Вычисления проводились автоматически при обработке допплеровских кривых.
Наряду с этим обследование пациентов включало: общеклинические анализы крови и мочи, биохимический анализ крови с определением уровня гликозилированного гемоглобина, показателей, отражающих функциональное состояние почек (СКФ в пробе Реберга-Тареева, суточная МАУ, креатинин сыворотки крови).
У всех обследованных больных азотвыделительная функция почек была сохранной, уровень креатинина в пределах нормы. Гликозилированный гемоглобин в среднем по группе составил 9,30 ± 3,90 (М ± m) %. Повышенный уровень гликозилированного гемоглобина выявлен у 41 (68%) человека. СКФ оказалась повышенной (более 140 мл/мин/м2) у 13 (22%) пациентов, остальные имели нормальные (80-140 мл/мин/м2) показатели СКФ. МАУ (суточная экскреция альбумина 30-300 мг) выявлена у 32 (53,3%) больных, у 5 (8,3%) больных зарегистрирована протеинурия. Больным проводилось суточное мониторирование артериального давления. Артериальная гипертензия (АГ) зарегистрирована у 14 (23,3%) больных.
Достоверность различий между группами оценивалась с помощью критерия Стьюдента. Использовались также методы корреляционного анализа с помощью стандартного пакета "Statistica 4,5"
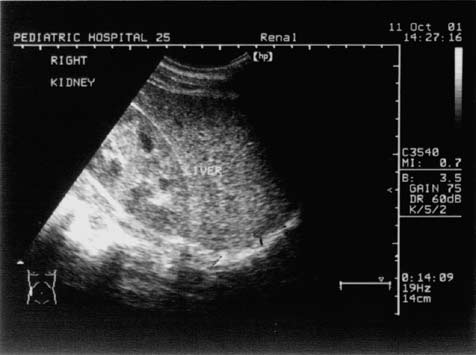
При исследовании в В-режиме контуры почек у всех пациентов были четкими, ровными. У 15 (24%) пациентов обнаружены повышение эхогенности кортикального слоя (синдром склеротических изменений — рис. 1) и наличие эхоплотного кольца по периферии почечных пирамидок (синдром "эхоплотного перимедуллярного кольца" — рис. 2). Этиологию этого явления связывают с уплотнением стенок aa. interlobares renis [5]. Данные изменения обнаруживались при длительности СД более 5 лет и достоверно коррелировали с МАУ (r = 0,304), артериальной гипертензией (r = 0,414) и уродинамическими нарушениями (r = 0,400).. Нарушения уродинамики, выявленные при проведении УЗИ у 27 (45%) пациентов, проявлялись гипотонией чашечно-лоханочной системы от незначительной (дилатация лоханок 7-9 мм) до выраженной пиелоэктазии (дилатация лоханки 15-17,5 мм) (рис. 3). Интересно, что гипотония почечных синусов достоверно коррелировала с повышенным уровнем гликированного гемоглобина (r = 0,462). Этот факт свидетельствует о том, что в этиологии данного явления играет роль длительная декомпенсация основного заболевания, сопровождающаяся гиперперфузией почек и выраженной полиурией.
 |
| Рис. 1. Эхограмма почки больной У., 18 лет. Повышение эхогенности кортикального слоя (синдром склеротических изменений). |
В группе пациентов с гиперфильтрацией при исследовании сосудистого русла в режимах ЦДК и ЭД подкапсульный кровоток хорошо визуализировался. Однако обнаружено повышение показателей гемодинамики на всех уровнях кровотока по сравнению с контрольной группой (табл. 1).
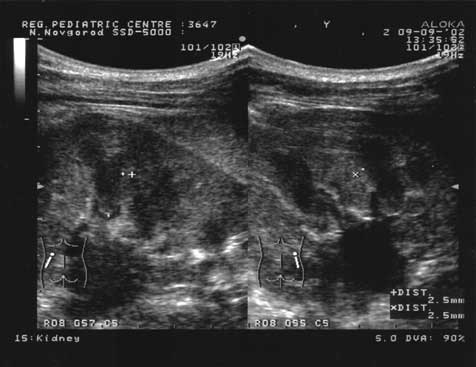 |
| Рис. 2. Эхограмма почек больного Г., 14 лет. Наличие эхоплотного кольца по периферии пирамидок (отмечено ++). |
 |
| Рис. 3. Эхограмма почек больного Г., 14 лет, демонстрирующая выраженную пиелоэктазию (отмечено ++). |
| Группы | Показатель | МПА | СА | МА | ДА | МДА | |
| Здоровые n=12 | S/D | 1 | 2,62 ± 0,44 | 2,62 ± 0,43 | 2,45 ± 0,19 | 2,31 ± 0,31 | 2,30 ± 0,32 |
| PI | 2 | 1,04 ± 0,20 | 1,07 ± 0,22 | 0,97 ± 0,13 | 0,89 ± 0,15 | 0,86 ± 0,15 | |
| RI | 3 | 0,59 ± 0,07 | 0,59 ± 0,05 | 0,59 ± 0,05 | 0,56 ± 0,05 | 0,56 ± 0,05 | |
| СКФ>140 мл/мин/м2 n=13 | S/D | 4 | 3,43 ± 0,40 | 2,96 ± 0,47 | 2,79 ± 0,36 | 2,64 ± 0,57 | 2,42 ± 0,18 |
| PI | 5 | 1,39 ± 0,20 | 1,12 ± 0,24 | 1,06 ± 0,15 | 0,99 ± 0,21 | 0,94 ± 0,12 | |
| RI | 6 | 0,69 ± 0,05 | 0,65 ± 0,04 | 0,63 ± 0,04 | 0,61 ± 0,07 | 0,58 ± 0,03 |
| Показатель | МПА | СА | МА | ДА | МДА | Р |
| 1 | 2 | 3 | 4 | 5 | ||
| RI (здоровые) | 0,59 ± 0,07 | 0,59 ± 0,05 | 0,59 ± 0,05 | 0,56 ± 0,05 | 0,56 ± 0,05 | Р1-4, Р1-5 > 0,05 |
| RI (СКФ>140 мл/мин/м2) | 0,69 ± 0,05 | 0,65 ± 0,04 | 0,63 ± 0,04 | 0,61 ± 0,07 | 0,58 ± 0,03 | Р1-4, Р1-5 < 0,05 |
| Группы | Показатель | МПА | СА | МА | ДА | МДА | |
| Здоровые n=12 | S/D | 1 | 2,62 ± 0,44 | 2,60 ± 0,43 | 2,45 ± 0,19 | 2,31 ± 0,31 | 2,30 ± 0,32 |
| PI | 2 | 1,04 ± 0,20 | 1,02 ± 0,22 | 0,97 ± 0,13 | 0,89 ± 0,15 | 0,86 ± 0,15 | |
| RI | 3 | 0,59 ± 0,07 | 0,59 ± 0,05 | 0,59 ± 0,05 | 0,56 ± 0,05 | 0,56 ± 0,05 | |
| МАУ n=37 | S/D | 4 | 2,73 ± 0,37 | 2,56 ± 0,41 | 2,40 ± 0,32 | 2,31 ± 0,28 | 2,19 ± 0,27 |
| PI | 5 | 1,1 ± 0,20 | 0,97 ± 0,18 | 0,90 ± 0,11 | 0,88 ± 0,13 | 0,80 ± 0,13 | |
| RI | 6 | 0,62 ± 0,05 | 0,60 ± 0,04 | 0,58 ± 0,04 | 0,55 ± 0,03 | 0,54 ± 0,06 |
Как видно из таблицы 1, у этой группы больных индексы резистивности в МПА значительно превышают таковые у здоровых и достоверно от них отличаются.
В литературе встречаются разноречивые данные относительно допплерографических критериев поражения почек у больных сахарным диабетом (6-10). В нашем исследовании фаза гиперфильтрации диабетической нефропатии (одна из самых ранних стадий) на допплерограмме почечных сосудов отражается относительным повышением индексов гемодинамики. Это свидетельствует о том, что сосуды находятся в состоянии повышенного тонуса. Объяснить данный факт можно, исходя и патогенеза диабетической нефропатии. По данным многочисленных исследований в основе инициации и прогрессирования ДН лежат нарушения внутрипочечной гемодинамики, а именно — развитие внутриклубочковой гипертензии. Проявлением последней является гиперфильтрация. Резкое увеличение градиента внутриклубочкового давления на фоне развившейся гипергликемии было доказано с помощью микропункционных исследований (1). Почка обладает уникальной способностью саморегуляции почечного кровотока и клубочковой фильтрации — увеличение перфузионного давления сопровождается эквивалентным возрастанием сосудистого сопротивления. Согласно миогенной гипотезе саморегуляции почечного кровотока при повышении давления в афферентной артериоле (повышенное гидростатическое давление в клубочке передается на приносящие сосуды) растягиваются ее гладкомышечные волокна, что тотчас увеличивает их тонус, возрастает напряжение, сосуд суживается и повышается сопротивление току крови (11). Это обеспечивает какое-то время относительную стабильность кровотока в мелких афферентных сосудах и препятствует нарастанию внутриклубочковой гипертензии. В нашем исследовании в группе больных с гиперфильтрацией достоверное повышение индекса резистентности на МПА сопровождается его снижением к периферии практически до уровня показателей у здоровых (табл. 2).
Клинически эта стадия ДН проявляется увеличением СКФ, полиурией, незначительной МАУ (в пределах 100 мг/сут), отсутствием АГ.
При длительном поддержании повышенного гидростатического давления в клубочках и интраренальных сосудах, чему способствуют частые декомпенсации СД, истощаются физиологические компенсаторные механизмы и гипертрофированная сосудистая стенка начинает дилатироваться. Дилатация приносящего сосуда (увеличение площади его сечения) должна повлечь за собой повышение внутриклубочковой гипертензии. Но помимо миогенного механизма саморегуляции почечного кровотока, существует дополнительный — открытие шунтов между афферентным и эфферентным сосудами (11). Подключение этого механизма сопровождается снижением гидростатического давления в клубочках и сосудах, но одновременно ишемией клубочка и усугублением его склерозирования. По нашему мнению именно с этого момента имеет место переход патологического процесса в качественно новую прогностически менее благоприятную стадию.
По данным литературы на допплерограмме феномен артериовенозного шунтированя крови проявляется снижением показателей резистивности (12,13(, в нашем исследовании — их псевдонормализацией (табл. 3).
Клинически у больных с такой допплерограммой уменьшается и нормализуется СКФ, уровень МАУ увеличивается (100 и более мг/сут), появляется умеренная АГ (в нашем исследовании — у 40,6% пациентов с МАУ). В В-режиме у 12 (37,5%) пациентов с МАУ выявлены признаки нефропатии, в режиме ЭД у 12 (37,5%) пациентов имело место обеднение сосудистого рисунка в подкапсульной зоне.
 |
 |
 |
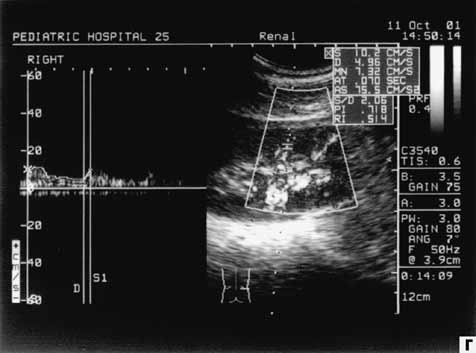 |
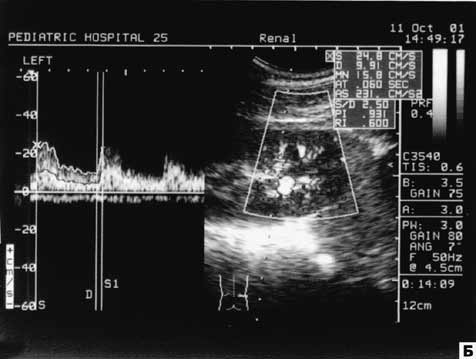
| Рис. 4. Допплерограммы почечных сосудов у больного с ДН (стадия протеинурии). А — допплерограмма МПА: скорость кровотока снижена, резистивные характеристики в норме. Б — допплерограмма СА: скорость кровотока снижена, резистивные характеристики в норме. В — допплерограмма МА: снижены скорость кровотока и резистивные характеристики. Г — допплерограмма ДА: снижены скорость кровотока и резистивные характеристики. |
У 5 (8,3%) больных с развернутой клиникой ДН (протеинурия, артериальная гипертензия, снижение СКФ) мы обнаружили следующие изменения: в В-режиме — выраженные диффузные изменения паренхимы почек со значительным повышением ее эхогенности, гипотонию чашечно-лоханочного комплекса; в режимах ЦДК и ЭД — значительное обеднение интраренального сосудистого рисунка. При исследовании допплеровской кривой выявлено парадоксальное явление — тенденция к снижению скорости кровотока в сочетании с низкими резистивными характеристиками в периферических почечных сосудах (рис. 4).
То есть, начальная стадия нефропатии (гиперфильтрация) характеризуется повышением индексов сосудистого сопротивления и достоверным их снижением к периферии до нормы. Данная картина является отражением физиологической миогенной компенсаторной реакции почечных сосудов, направленной на ликвидацию внутриклубочковой гипертензии и предотвращение повреждения почечных клубочков. Следующая стадия — микроальбуминурическая — сопровождается снижением (псевдонормализацией) показателей резистивности, что можно объяснить механизмом артериовенозного шунтирования крови, являющимся, в данном случае, средством патологической компенсации повышенного периферического сопротивления.
Таким образом, проведенное исследование продемонстрировало роль эхографии (прежде всего в D-, ЦДК- режимах и режиме энергетического допплера) в диагностике ДН, выявлении стадийности процесса и оценке его тяжести. Позволило выявить прогностически неблагоприятные допплерографические критерии поражения почек при СД. Достоверная корреляция показателей резистивности почечных сосудов с наиболее ранним проявлением ДН — клубочковой гиперфильтрацией позволяет рекомендовать исследование допплерометрических показателей почечной гемодинамики для подтверждения диагноза диабетической нефропатии на ранней доклинической стадии процесса и оценки прогноза дальнейшего его развития.